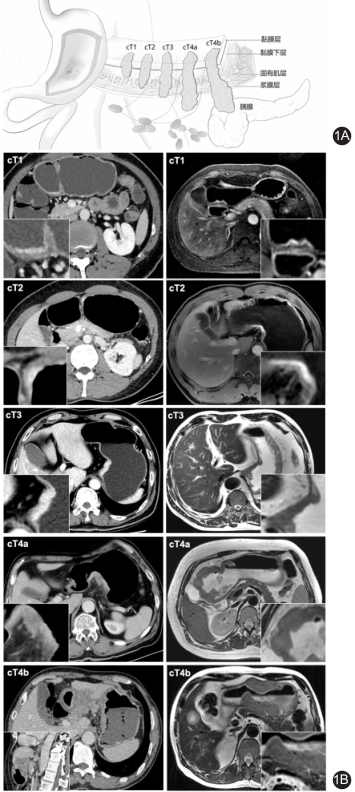
CT在胃癌中的应用 在世界范围内,胃癌发病率居于最常见的恶性肿瘤第五位,肿瘤相关死亡原因第三位. 2018年起有超过100万例新诊断,78.3万人估计死亡,此外超过40%的新发病例发生在中国。近年来,越来越多的研究报道,计算机断层扫描(CT)在胃癌患者中具有重要的临床应用价值,包括术前分期、治疗反应评估、预测预后和组织病理学特征、治疗指导和分子成像等。 1、CT在胃癌中的应用 随着科技的发展,CT除了多层螺旋平扫外,还包括了各种衍生应用。如增强 CT能初步判断肿瘤部位、肿瘤与周围脏器或血管关系及区分肿瘤与局部淋巴。正电子发射断层扫描(PET)已有效地运用于胃癌的随访和复发。PET-CT可作为进一步细化分期的影像学工具。多行检测器计算机断层扫描(MDCT)扫描仪允许更快的扫描、多平面重建、三维图像重建、虚拟内窥镜和对比增强检查,显著提高了胃癌的检出率。 2、术前分期 准确的术前分期是胃癌综合治疗的基础,对选择最佳治疗方法和预测预后起着至关重要作用。鉴别胃壁内肿瘤的范围和浸润以及淋巴结受累程度又与术前分期直接相关。在个性化治疗和多学科团队治疗的时代,临床医生越来越重视医学影像学在胃癌诊断和治疗中的价值。 CT目前为国际上胃癌分期和风险评估的常用检查手段和工具,也是国际癌首选临床分期手段,被广泛应用于术前分期中评估肿瘤深度浸润(T)和区域淋巴结浸润(N)。 据国际期刊上的一些报道,MDCT对T分期的总体诊断准确率为77.1%-88.9%[1-4],对N分期的诊断准确率为46%-92%。多行检测器计算机断层扫描(MDCT)扫描仪允许更快的扫描、多平面重建、三维图像重建、虚拟内窥镜和对比增强检查,显著提高了胃癌的检出率。据报道,MDCT对T分期的总体诊断准确率为77.1%-88.9%,对N分期的诊断准确率为46%-92%。 此外,胸部和盆腔CT是评估胃癌远处转移(M分期)的主要方式,其敏感性和特异性为14%~59.1%,及93.3%~99.8%。根据Christian R的研究结果,即使在西方按照术前分期和组织学分析进行淋巴结切除术,以胃为重点的CT扫描甚至可以取代术前内镜超声。 3、CT 纹理分析 近年来,CT 纹理分析(CT texture analysis,CTTA)方兴未艾,这是一种医学影像分析技术,是一种图像后处理方式,在肿瘤学领域中用以评估肿瘤的异质性和预后,它通过对CT图像的纹理特征进行量化分析,提取有关肿瘤内部结构和功能的信息。这种分析可以帮助医生更好地理解肿瘤的生长模式、血管分布等情况,从而为患者提供更个性化的治疗方案。 无论是平扫还是增强的图像都可以进行纹理分析。相比于胃镜活检可能会导致肿瘤破溃、出血,甚至有发生肿瘤腹腔种植的危险,CT 纹理分析在肿瘤诊断方面具有很大的潜力,有望成为一种重要的辅助工具。 CT纹理分析的应用主要包括以下几个方面: 评估异质性及预后:肿瘤内部的不同区域可能具有不同的生长速度和血管分布,这种异质性是肿瘤侵袭性和预后不良的标志。通过CT纹理分析,可以量化这种异质性,帮助医生评估肿瘤的恶性程度和患者的预后,而CT 纹理分析广泛运用于胃癌分型具有重要的预后价值,通过分析CT图像的纹理特征,可以预测患者的治疗效果。例如,其鉴别 BORRmann Ⅳ型胃癌和胃淋巴瘤的灵敏度和特异度分别为 86.67% 和 82.50%,当与放射科医生的主观诊断一起建立组合预测模型时,特异度可达 100%[7]。 辅助诊断和治疗计划:CT纹理分析还可以帮助医生更准确地诊断疾病,并提供个性化的治疗建议。例如,可以在胃癌隐匿性腹膜转移的预测,从晚期患者中筛选出对新辅助化疗敏感的患者和反应较差及无反应患者,就能为患者个性化地制定精准化疗方案。 4、术后随访 在术后随访的应用中,日本胃癌指南推荐胃癌患者进行常规术后随访,积极的术后随访策略能够早期发现疾病复发和进展,并尽早实施治疗干预[9-10],而CT已是《日本胃癌指南》中所推荐的,术后每半年进行一次的常规项目。另外,随着CT的发展,还衍生出了18F-FDG PET/CT和[68Ga]Ga-DOTA-FAPI-04 PET/CT等,它们在诊断复发上具有重要价值,是CT在随访中的补充[11-12]。 从以上的研究可以看出,CT在胃癌的分期、鉴别、转移风险评估、疗效预后评估以及术后随访方面有很大的潜力,与现在临床上所用的检查监测手段相比,具有无创、客观、全面、经济等诸多优势。
1. Kwee Robert Michael,Kwee Thomas Christian,Imaging in local staging of gastric cancer: a systematic review.[J] .J Clin Oncol, 2007, 25: 2107-16.
2.Polkowski M,Palucki J,Wronska E et al. Endosonography versus helical computed tomography for locoregional staging of gastric cancer.[J] .Endoscopy, 2004, 36: 617-23.
3.Yang Dal Mo,Kim Hyun Cheol,Jin Wook et al. 64 multidetector-row computed tomography for preoperative evaluation of gastric cancer: histological cORRelation.[J] .J Comput Assist Tomogr, 2007, 31: 98-103.
4. Ahn HS, Lee HJ, Yoo MW, et al. Diagnostic accuracy of T and N stages with endoscopy, stomach protocol CT, and endoscopic ultRASonography in early gastric cancer. J Surg Oncol 2009;99:20–27
5.Ma ZL, Fang MJ, Huang YQ, et al. CT-based radiomics signature for differentiating Borrmann type IV gastric cancer from primary gastric lymphoma. Eur J Radiol, 2017, 91(91): 142-147
6.Park, J., et al., Detection of asymptomatic recurrence improves survival of gastric cancer patients. Cancer medicine, 2021. 10(10): p. 3249-3260.
7.Villarreal-Garza, C., et al., Improved outcome in asymptomatic recurrence following curative surgery for gastric cancer. Medical oncology (Northwood, London, England), 2011. 28(4): p. 973-80.
8.Lee, J., et al., Diagnostic performance of FDG PET/CT for surveillance in asymptomatic gastric cancer patients after curative surgical resection. European journal of nuclear medicine and molecular imaging, 2016. 43(5): p. 881-888.
9.Zhao, L., et al., Role of [Ga]Ga-DOTA-FAPI-04 PET/CT in the evaluation of peritoneal carcinomatosis and comparison with [F]-FDG PET/CT. European journal of nuclear medicine and molecular imaging, 2021. 48(6): p. 1944-1955.